Антагонист лейкотриеновых рецепторов вред или польза

- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Пронина И.В. 1
1 ФГБОУ ВО Пермский государственный медицинский университет им. Акад. Е.А.Вагнера Минздрава России
Лейкотриены – это биологически активные вещества, производные жирных кислот и являющиеся местными и системными гормонами. Лейкотриены С4, D4 и Е4 относятся к цистеинил лейкотриенам, участвующим в бронхоконстрикции и воспалительной реакции при бронхиальной астме. Именно поэтому они были названы медленно реагирующей субстанцией анафилаксии (МРСА) еще в 1940г. А их химическая структура была открыта в конце 1970-х годов. Эти открытия привели к созданию антилейкотриеновых препартов, используемых для лечения бронхиальной астмы. По механизму действия их можно разделить на 2 группы: блокаторы синтеза лейкотриенов и блокаторы лейкотриеновых рецепторов. К 1-ой группе относятся Зилеутон, а ко 2-ой Зафирлукаст, Монтелукаст и др. Антилейкотриеновые препараты можно рассматривать как аналоги ингаляционных кортикостероидов или бэта-агонистов в терапии бронхиальной астмы или, наоборот, как сочетание с этими группами лекарственных средств. Таким образом, антилейкотриены теоретически могут иметь достаточно широкое применение в лечении БА. В данной статье мы рассмотрели результаты некоторых исследований по изучению эффективности антилейкотриенов в терапии бронхиальной астмы, а также привели рекомендации Российского респираторного общества по использованию антилейкотриенов в лечении БА.
лейкотриены
антилейкотриены
бронхиальная астма
монтелукаст
1. Бронхиальная астма. МОО Российское респираторное общество. Российская ассоциация аллергологов и клинических иммунологов. МКБ 10: J.45, J.46О Год утверждения (частота пересмотра): 2018 (пересмотр каждые 3 года)
2. Хаитов Р. М. Иммунология: учебник для студентов медицинских вузов. – М.: ГЭОТАР-Медиа, 2006. – 320 с.
3. Харкевич Д. А. Фармакология. Учебник. – 12-е издание, перераб. доп. и испр. – М.: ГЭОТАР-Медиа, 2017. – 736с. с.: ил.
4. Цой А. Н., Архипова В. В. Бронхиальная астма. Новые решения. – М.: МИА, 2007. – 311 с.
5. Ярилин А. А. Иммунология: учебник. – М.: ГЭОТАР-Медиа, 2010. – 752 c.
6. Cingi C, Muluk NB, Ipci K, Şahin E. Antileukotrienes in upper airway inflammatory diseases. Current allergy and asthma report. Springer Science+Business New York 2015
7. Matsuse H., Tsuchida T., Fukahori S. et al. Retrospective cohort study of leukotriene receptor antagonist therapy for preventing upper respiratory infection-induced acute asthma exacerbations // Allergy Rhinol. (Providence). 2013. Vol. 4. № 3. P. e127-131.
8. Samuelsson B. Leukotrienes: tors of imte hypersensitivity reactions and inflammation. Science 1983;220:568-75.
Лейкотриены – это биологически активные производные 20-углеродных полиненасыщенных жирных кислот. Они имеют широкий спектр биологической активности и выполняют функции как тканевых, так и системных гормонов.
История открытия лейкотриенов начинается в 1938 году, когда W. Feldberg и C.H. Kellaway занимались изучением влияния яда кобры на легкие морских свинок и обнаружили в перфузате легких вещество, способное вызывать медленное, стойкое сокращение гладких мышц. В 1940 г. C.H. Kellaway и E.R. Trethewie заметили, что это сокращение отличается по продолжительности от сокращения, вызываемого гистамином, и назвали новый медиатор медленно реагирующей субстанцией анафилаксии (МРС-А). В 1960 г. W. Brocklehurst заметил, что при добавлении аллергена к фрагментам легкого, взятых у больного бронхиальной астмой, в них вырабатывается МРСА. Это свидетельствует о том, что МРС-А – медиатор, отвечающий за симптоматику бронхиальной астмы, так как он вызывает более длительный бронхоспазм, чем другой бронхоконстриктор, например, гистамин. А в конце 70-х ученым удалось выяснить, что МРС-А является лейкотриенами. И после этого открытия учеными были предприняты попытки создания лекарств, являющихся ингибиторами синтеза и антагонистами лейкотриенов, которые используются при лечении бронхиальной астмы. [2]
Синтез лейкотриенов – это сложный, многоступенчатый процесс, который начинается с отщепления арахидоновой кислоты от фосфолипидов цитоплазматической мембраны с помощью фермента фосфолипаза А2. Далее арахидоновая кислота может трансформироваться двумя путями: под влиянием циклооксигеназы она превращается в простагландины, а под влиянием липоксигеназной ферментной системы в лейкотриены. Липоксигеназная ферментная система относится к растворимым цитозольным ферментам, они обнаружены в цитоплазме альвеолярных макрофагах, тромбоцитах, тучных клетках и лейкоцитах. Наиболее важным ферментом является 5-липоксигеназа (5-ЛОГ). Арахидоновая кислота под воздействием комплекса 5-ЛОГ превращается в оксиэйкозатетраеновые кислоты, из которой в свою очередь образуется LТА4. Во внутриклеточной среде к LТА4 под действием LТС4- синтазы присоединяется глутатион и образуется LТС4. Далее LТС4 выходит во внеклеточную среду, где от него отщепляется остаток глутаминовой кислоты и образуется лейкотриен D4. LТЕ4 образуется при отщеплении остатка глицина от LТD4. (рис.1) Лейкотриены С4, D4 и Е4 содержат цистеин, поэтому их называют цистеиновыми лейкотриенами. Именно цистеиниловые лейкотриены были названы МРС-А. Они имеют одно действие, но лейкотриен Е4 имеет меньшую активность. Ферментные системы, необходимые для синтеза лейкотриенов, были обнаружены в альвеолярных макрофагах, тучных клетках и лейкоцитах. А именно эозинофилы и тучные клетки являются основными эффекторами в патогенезе астмы. [4]
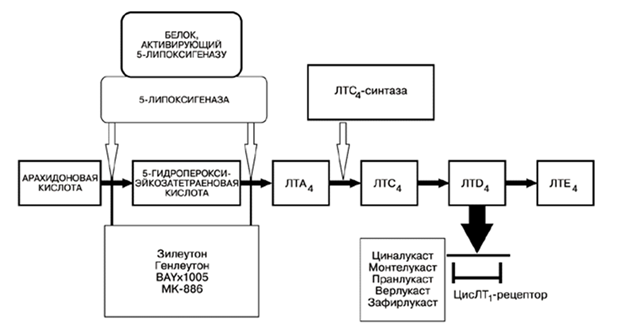
Рис. 1. Биосинтез цистеинил лейкотриенов.
Биологическое действие лейкотриенов опосредовано через рецепторы, которые относятся к группе пуриновых рецепторов, 7-кратно пронизывающих мембрану и связанных с G-белком. По специфическому связыванию с лигандами они делятся на 2 подкласса: связывающиеся с лейкотриеном B4, называемые BLT рецепторами, и цистеинил лейкотриеновые рецепторы – CysLTR. Эндогенными лигандами цистеинил лейкотриеновых рецепторов являются лейкотриены C4, D4 и E4.
Основное биологическое действие LTB4 заключается в стимуляции хемотаксиса, активации макрофагов и синтезе хемокинов и цитокинов. Считается, что он играет важную роль в формировании гнойного воспаления, ревматоидного артрита и других воспалительных заболеваниях. Однако его роль в патогенезе бронхиальной астмы не ясна, так как при использовании антагонистов рецепторов к LTB4 для лечения БА симптоматика не меняется.[5]
Выделяют две разновидности цистеинил лейкотриеновых рецепторов: CysLTR1 и CysLTR2. Эксперименты на мышах с дефицитом CysLTR2 или сверхэкспрессией CysLTR2 в легких показали, что CysLTR2 не способствуют бронхоспазму, а скорее способствуют воспалению, проницаемости сосудов и фиброзу тканей. Цистеиниловые лейкотриены повышают экспрессию таких молекул адгезии, как Р-селектин, который опосредует адгезию лейкоцитов к эндотелию сосудов в процессе острого воспаления. Модификаторы лейкотриенов могут снижать экспрессию цитокинов, блокируя их действия. Обратное явление также верно: цитокины могут модулировать экспрессию лейкотриенов. В целом цистеиниловые лейкотриены вызывают расширение периферических и сужение коронарных сосудов, увеличивают проницаемость бронхов, подавляют пролиферацию лимфоцитов и способствуют их дифференцировке. Ингаляции LTE4 увеличивают число эозинофилов в биоптате дыхательных путей, а ингаляции LTD4 повышают число эозинофилов в мокроте больных с бронхиальной астмой. Также именно этот комплекс ответственен за медленную фазу бронхоспазма при бронхиальной астме. [2,5]
Это объясняет усугубление астматических приступов у больных с непереносимостью нестероидных противовоспалительных препаратов (НПВП). У таких больных в бронхах увеличена экспрессия LTC4-синтазы, что приводит к увеличению продукции цистеиниллейкотриенов. Частичным объяснением этого явления может быть генетический полиморфизм гена LTC4-синтазы. Общий вариант промотора гена создает предрасположенность к аспириновой астме(АА) путем усиления эффекторного механизма бронхоконстрикции. Исследования с аспирином в сочетании с оценкой полиморфизма синтазы LTC 4 и экскреции LTC 4 с мочой указывают на некоторую гетерогенность среди пациентов с AA. Они тормозят образование простагландинов, высвобождая метаболический шунт арахидоновой кислоты в пользу лейкотриенов. Это проявляется в виде покраснений кожных покровов, приступов удушья и кашля, подъема температуры, конъюнктивита и отека Квинке. Степень аллергической реакции на НПВП зависит от антициклооксигеназной активности препарата и его количества. К препаратам с высокой антициклооксигеназной активностью относятся салицилаты (аспирин), полициклические кислоты (индометацин, толметин), ненасыщенные жирные кислоты (диклофенак, ибупрофен, кетопрофен, тиапрофеновая кислота), оксикамы (пироксикам, лорноксикам). [5]
Исходя из выше сказанного для лечения бронхиальной астмы, особенно у пациентов с непереносимостью НПВП, можно применять препараты, действующие на лейкотриеновую систему – антилейкотриены. С теоретической точки зрения, подавить активность лейкотриенов можно двумя путями: первый, это ингибировать их синтез, воздействуя на ферментную систему (в настоящее время удалось ингибировать только фермент 5-липоксигеназу), а второй это препятствовать связыванию лейкотриенов с их рецепторами. На рисунке 1 также показаны основные места действия различных антилейкотриенов. [4]
К первой группе этих препаратов относятся зилеутон (Zileuton) и генлеутон. Они явдяются антагонистами белка, активирующего 5-липоксигеназу. Ко второй антагонисты цистеинил лейкотриеновых рецепторов (CysLTR) – зафирлукаст (Zafirlucast), монтелукаст, циналукаст.
Зилеутон принимают перорально и он быстро всасывается. Жирная пища стимулирует его абсорбцию. При первом прохождении через печень из него образуются глюкурониды. Максимальная концентрация в крови наблюдается через 1,8-2,5 ч. Метаболиты выделяются почками. t ~ 1-2,3 ч. Препарат рекомендован для применения взрослым. [3]
Результаты исследования A.R. Fischer et al. Показали, что прием Зилеутона не только уменьшает воспаление дыхательных путей, но и снижает их реактивность, то есть уменьшается степень и скорость сужения бронхов после контакта с бронхоконстрикторами. [7] Зилеутон помимо лечения бронхиальной астмы может использоваться и при ревматоидном артрите и язвенном колите. При применении Зилеутона возможны побочные эффекты: лихорадка, миалгия, утомляемость, головокружения, головная боль, диспепсия, повышение уровня трансаминаз и другие. [3]
Зафирлукаст избирательно и длительно блокирует рецепторы для LTE4 и LTD4 и обладает выраженным противовоспалительным действием. При бронхиальной астме это проявляется в виде уменьшения проницаемости сосудов, снижения отека слизистой, секреции густой мокроты, расширении бронхиол. Также было замечено, что зафирлукаст блокирует микросомальные ферменты, что сказывается на метаболизме и фармакокинетике других лекарств. Клинический эффект препарата развивается примерно через одни сутки, поэтому он используется для профилактики и длительного лечения бронхиальной астмы. Для купирования острых астматических приступов данный препарат не пригоден. Но он может использоваться в совокупности с быстродействующими антиастматическими лекарственными средствами. [6] Применение зафирлукаста может вызвать такие побочные действия, как головная боль, гастрит, фарингит, миалгия, артралгия и другие.
Препарат принимается перорально, хотя эффективен и при ингаляции. Максимальная концентрация определяется через 3 часа. Приимать следует натощак, так как наличие пищевых масс в кишечнике уменьшает всасывание на 40%. Через гематоэнцефалический барьер проникает плохо. Его метаболиты выделяются кишечником и почками, t ~ 10 ч. Рекомендован для применения взрослым и детям старше 5 лет. [3]
Также к блокаторам антилейкотриеновых рецепторов относится Монтелукаст. Он является избирательным антагонистом LTD4, но в отличие от Зафирлукаста не ингибирует микросомальные ферменты, поэтому не влияет на фармакокинетику других препаратов. Известно, что при блокаде CysLTR1 Монтелукастом значительно снижается эозинофильное воспаление, что сопровождается количественным уменьшением медиаторов: нейрокинина А и вещества Р в лаважной, назальной жидкости пациентов с полиппозом носа и астмой, с непереносимостью НПВС или без нее. [8]
Монтелукаст вводится внутрь, всасывается быстро. Его абсорбция от состава пищи не зависит. Метаболиты выделяются в основном кишечником. t ~ 2,7-5,5 ч. Область применения такая же, как и у Зафирлукаста, но препарат рекомендован для применения взрослым и детям старше 6 месяцев. [3]
Majak P и Stelmach I. в своей работе указали, что Монтелукаст, по-видимому, является лучшим вариантом терапевтического лечения астмы физического усилия. Интересно, что Монтелукаст может обладать некоторой профилактической активностью в отношении вирусных обострений астмы. Существуют убедительные доказательства клинической эффективности Монтелукаста при всех фенотипах астмы, что делает этот препарат наиболее универсальным вариантом лечения против астмы. Тем не менее, существует индивидуальная вариабельность ответа на Монтелукаст, которая наблюдается для всех лекарств, обычно используемых для лечения астмы. Из побочных эффектов могут быть головная боль, диспепсические расстройства, головокружения , кожные высыпания и другие.
Зафирлукаст и Монтелукаст, в настоящее время, активно не используются в связи с низкой эффективностью и высокой стоимостью. Однако они имеют и свои преимущества: простой режим лечения, 1-2-кратный прием и появление эффекта в течение 24 часов после приема препарата. Также на фоне приема антилейкотриенов возможно развитие синдрома Черджа-Стросса, однако этот факт требует дальнейшего изучения. И в современной медицинской практике антагонисты лейкотриенов не применяются для куппирования приступов бронхиальной астмы. [8]
Антилейкотриены могут служить альтернативой монотерапии ингаляционными кортикостероидами при лечении легкой персистирующей астмы у взрослых и детей. Но из-за плохого контроля над астмой и, как следствие, возникновения приступов, и последующего назначения кортикостероидов использование лейкотриенов для монотерапии бронхиальной астмы пока остается под вопросом. Однако применение ингибиторов синтеза лейкотриенов может снизить необходимость экстренного применения ингаляционных стероидов или системного лечения стероидами. [6]
Изучение Конкрейновской базы данных показало, что использование антилейкотриенов при астме менее эффективно, чем использование ингаляционных кортикостероидов (ИГКС). Была проведена оценка 14 эксперементов, 12 из которых были проведены у взрослых, одно у взрослых и подростков (≥ 12лет), одно у детей ( ~10 лет). Продолжительность вмещательства варьировала от 4 до 37 недель. Из антилейкотриеновых препаратов использовали монтелукаст, пранлукаст и зафирлукаст. У пациентов, получавших антилейкотриены больше, чем кортикостероиды, наблюдалось увеличение обострений бронхиальной астмы. Из этого следует вывод, что применение кортикостероидов более эффективно. [7]
В нашей стране антилейкотриены обозначаются как дополнительная терапия в совокупности с ингаляционными кортикостероидами и являются альтернативой длительно действующим β2-агонистам при персистирующей бронхиальной астме. Но по сравнению с β2-агонистами монтелукаст менее эффективен и к тому же более дорогой.
Современная терапия бронхиальной астмы должна отвечать поставленным целям:
1. Достижение и поддержание контроля симптомов БА в течение длительного времени;
2. Минимизация рисков будущих обострений БА.
Именно поэтому был разработан специальный ступенчатый подход к ее лечению. Каждая ступень соответствует определенной выраженности клинических проявлений БА и представляет собой варианты ее терапии. По данной схеме антилейкотриены могут применять на 2, 3 и 4 ступенях.
На 2 ступени антилейкотриены рекомендуются для терапии пациентам с БА в сочетании с аллергическим ринитом, пациетам с вирусиндуцированной БА, с астмой физического усилия. На 3 ступени – у детей младше 5 лет в качестве дополнения к терапии ИГКС; у детей старше 5 лет лечения БА в качестве дополнения к базисной терапии низкими/средними дозами ИГКС. На 4 ступени детям 5-12 лет с неконтролируемым течением БА на фоне терапии 400 мкг беклометазона дипропионата или его эквивалнента в день в комбинации с длительно действующими бэта-агонистами (ДДБА) рекомендуется увеличение дозы ИГКС до максимальной в сочетании с ДДБА или добавление антилейкотриенов. (рис. 2) [1]
Таким образом, несмотря на большое количество исследований в данной области, эффективность применения антилейкотриеновых препаратов до сих пор остается под вопросом. При их назначении необходимо учитывать соотношение польза/вред, стадию течения бронхиальной астмы, индивидуальные реакции организма на препарат. Но одно можно сказать точно, антилейкотриеновые препараты – это достаточно перспективное направление в области лечения бронхиальной астмы, которое при дальнейшем развитии может привести к разработке новых препаратов и снижении побочных эффектов уже существующих.

Рисунок 2. Ступенчатая терапия бронхиальной астмы.
Библиографическая ссылка
Пронина И.В. ЛЕЙКОТРИЕНЫ И СОВРЕМЕННЫЙ ВЗГЛЯД НА ПРИМЕНЕНИЕ ИХ АНТАГОНИСТОВ В ЛЕЧЕНИИ БРОНХИАЛЬНОЙ АСТМЫ // Международный студенческий научный вестник. – 2020. – № 2.;
URL: https://eduherald.ru/ru/article/view?id=19978 (дата обращения: 07.05.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Статьи
Опубликовано в журнале:
Южно-Российский медицинский журнал »» N 1-2 / 2001 Пульмонология Голубев Л.А., Бабак С.Л., Григорьянц Г.А.
Московский НИИ пульмонологии
Бронхиальная астма – хроническое воспалительное заболевание дыхательных путей, являющееся серьезной проблемой здравоохранения всех стран мира [2]. Астма распространена во всех возрастных группах и часто имеет тяжелое фатальное течение. Более 100 млн. человек страдает этим заболеванием, и их число постоянно возрастает.
Ведущая роль воспаления в развитии астмы – признанный факт, в возникновении которого принимают участие многие клетки: эозинофилы, тучные клетки, Т-лимфоцтиы [25]. У предрасположенных лиц это воспаление приводит к повторяющимся эпизодам хрипов, одышки, тяжести в грудной клетке и кашлю, особенно ночью и ранние утренние часы [3, 4]. Эти симптомы сопровождаются распространенной обструкцией бронхиального дерева, которая, по крайней мере частично, обратима спонтанно или под влиянием лечения. Воспаление также вызывает усиление ответа дыхательных путей на различные стимулы.
В развитии воспаления важное значение имеют генетические факторы, в частности, атопия. В то же время имеется большое количество доказательств, что факторы окружающей среды являются факторами риска и могут приводить к дебюту заболевания.
Вдыхание аллергенов домашнего клеща, пассивное курение являются особенно важными. К факторам риска также относятся воздействие выбросов автомобилей и профессиональных сенсибилизаторов. Развивающееся воспаление ведет к развитию гиперреактивности бронхов, их обструкции, что поддерживается триггерными механизмами [5].
Хроническое воспаление характерно для астмы вне зависимости от ее тяжести. Воспаление сопровождается развитием гиперреактивности бронхов и бронхиальной обструкции, являющихся двумя определяющими факторами, лежащими в основе нарушения легочной функции. Гиперреактивность дыхательных путей проявляется в чрезмерной бронхоконстрикторной реакции на различные раздражители. Бронхи являются важным компонентом в этой реакции. [5].
Бронхиальная гиперреактивность – обязательный признак бронхиальной астмы и тесно связана с тяжестью заболевания и частотой возникновения симптомов. Данные свидетельствуют о том, что существует тесная связь между бронхиальной гиперреактивностью и воспалением слизистой дыхательных путей [22], с инфильтрацией их стенок эфферентными клетками воспаления, среди которых преобладают тучные клетки, эозинофилы и актививированные лимфоциты. Эозинофильная инфильтрация дыхательных путей является характерной чертой при астме и позволяет дифференцировать это заболевание от других воспалительных процессов дыхательных путей. [28]. Клетки высвобождают различные медиаторы воспаления, включая лейкотриены – ЛТС4, ЛТВ4, тромбоксан, кислородные радикалы, основные белки, эозинофильный катионный белок, которые токсичны для эпителия бронхов [23].
В патогенез бронхиальной астмы вовлечены различные медиаторы, продуцирующиеся этими клетками, которые вносят свой вклад в повышение бронхиальной реактивности и клинические проявления астмы. Такие медиаторы, как гистамин, простагландины и лейкотриены непосредственно приводят к сокращению гладкой мускулатуры дыхательных путей, повышению проницаемости сосудов, увеличению секреции слизи в просвет дыхательных путей, активируют другие воспалительные клетки, высвобождающие вторичные медиаторы воспаления.
Одним из механизмов нарушения функции дыхания является бронхиальная обструкция.
По данным P.Devillier и соавт. [17] в основе обструкции дыхательных путей лежит сокращение гладкой мускулатуры бронхов, отек слизистой, увеличение секреции слизи и инфильтрация дыхательных путей клетками воспаления (преимущественно эозинофилами).
В последние годы в патогенезе бронхиальной астмы выявлена роль посредников воспаления нового класса, получивших название лейкотриены.
История открытия лейкотриенов [15, 22] связана с исследованием медленно реагирующей субстанции анафилаксии (SAS-A), Broklekast, 1960.
В 1983 г. B.Samuelsson индентифицировал LTC4, LTD4 и LTE4. В 1993 г. L.Laltlnen и соавт. и в 1997 г. Z.Diamant и соавт. [19] описали триггерную реакцию при активизации рецепторов цистеинил-лейкотриенов в дыхательных путях и клетках воспаления, эффект бронхоконстрикции, отек тканей, секрецию слизи в дыхательных путях и стимуляцию клеток воспаления в легочной ткани. Цистеинил-лейкотриены являлись медиаторами обструкции дыхательных путей при астме.
Лейкотриены образуются из арахидоновой кислоты при участии липоксигеназы. Лейкотриены синтезируются различными клетками [31, 26] под воздействием специфических стимулов: IgE, IgJ, эндотоксинов, факторов фагоцитоза.
Основное место синтеза лейкотриенов в организме человека – легкие, аорта и тонкий кишечник. Наиболее интенсивно синтез лейкотриенов осуществляется альвеолярными макрофагами, нейтрофилами и эозинофилами.
Роль лейкотриенов в патогенезе бронхиальной астмы заключается в усилении секреции слизи, подавлении ее клиренса, увеличении выработки катионных белков, повреждающих эпителиальные клетки. Лейкотриены усиливают приток эозинофилов, повышают проницаемость кровеносных сосудов. Они ведут к сокращению гладких мышц бронхов, способствуют миграции клеток, участвующих в развитии воспалительного процесса (активированные Т-клетки, тучные клетки, эозинофилы) [13, 35, 39]. В ряде исследований показано, что у больных бронхиальной астмой в моче обнаруживается лейкотриен Е4 [20].
LTC4 и LTD4 обладают мощным бронхоконстрикторным действием. Эффект бронхоспазма, в отличие от вызванного гистамином, развивается медленнее, но является более продолжительным. Лейкотриены усиливают проницаемость сосудов в 1000 раз эффективнее гистамина. Повышение проницаемости венул объясняется образованием щелей за счет сокращения эндотелия. LTD4 более активно влияет на процесс усиления секреции слизи слизистой оболочкой бронхов.
Установлено, что лейкотриены В4, С4, D4, Е4 играют важную роль в механизмах воспаления и вызывают изменения, характерные для бронхиальной астмы [6, 35]. Лейкотриены С4, D4 приводят к ранним изменениям и вызывают миграцию клеток в зону воспаления дыхательных путей.
Клинические эффекты лейкотриена В4 обуславливают хемотаксис лейкоцитов, адгезию нейтрофилов к эндотелию, освобождение протеаз и образование супероксида нейтрофилами. Это способствует повышению проницаемости капилляров. Лейкотриены D4, С4 и Е4 приводят к спазму гладкой мускулатуры бронхов, развитию отека, привлечению эозинофилов, повышению секреции слизи и нарушению ее транспорта.
Установлено, что лейкотриены связываются рецепторами, локализованными на плазматических мембранах клеток [7]. Выделено три основных типа рецепторов лейкотриенов.
1. Рецептор LTI к лейкотриенам LTC/D/E4. Данный рецептор опосредует бронхоконстрикторный эффект лейкотриенов.
2. Рецептор LT2 к LTC/D/E4; ему принадлежит важная роль в контроле над сосудистой проницаемостью.
3. Рецептор LTB4 опосредует хемотаксический эффект лейкотриенов.
Ингибиторы рецепторов лейкотриенов
Представления о лейкотриенах, как о медиаторах воспаления, позволили разработать концепцию создания нового класса лекарственных препаратов, получивших название “антилейкотриеновые субстанции” [7, 12].
Антилейкотриеновые субстанции включают в себя антагонисты рецепторов к цистеиновым лейкотриенам и препараты, ингибирующие синтез лейкотриенов [24].
Создание лекарственных препаратов, влияющих на синтез лейкотриенов, осуществляется в следующих направлениях. [1, 9, 21, 34, 36].
1. Создание антагонистов рецепторов лейкотриенов. К ним относятся зафирлукаст (акколат, субстанция 1С1204219) пранлукаст (субстанция ONO-1078), побилукаст (субстанция SKF 104353), монтелукаст (сингуляр, субстанция МЛ-0476).
2. Поиск ингибиторов 5-липоксигеназы. Представителем этой группы препаратов является зилеутон (субстанция Ф-64077).
Экспериментальными исследованиями показано, что антагонисты рецепторов лейкотриенов препятствовали развитию бронхоспазма, снижали количество воспалительных клеток (лимфоцитов и эозинофилов) в бронхоальвеолярной жидкости. Данные клинических исследований свидетельствуют о том, что антагонисты лейкотриеновых рецепторов предупреждают развитие симптомов бронхиальной астмы, улучшают функцию легких [40].
Показано, что in vitro антагонисты цистеинил-лейкотриенов конкурируют с лейкотриеном D4 за связь с рецепторами, которые присутствуют в мембранах клеток легких морских свинок и человека [16]. Их сходство с лейкотриеном D4 превышает естественный лиганд примерно в два раза. Антагонисты лейкотриенов (зафирлукаст, монтелукаст, побилукаст) блокируют лейкотриены D4 и Е4, вызывающие сокращение гладкой мускулатуры изолированной трахеи морской свинки, но не блокируют спазм, вызванный лейкотриеном С4. Под их влиянием уменьшается концентрация медиаторов воспаления в зоне развития воспалительного процесса, тормозится заключительная фаза антигениндуцированного бронхоспазма, обеспечивается защита при различных провокациях. [8, 10, 11, 30, 32, 33, 36]
Все ингибиторы рецепторов лейкотриенов с различной степенью активности предупреждают LTD4-индуцированную бронхоконстрикцию [30]. Они блокируют ранний и поздний ответ на воздействие антигена, эффекты на влияние холода и аспирина, увеличивают FEV при легкой и умеренной астме, снижают применение бета-агонистов, усиливают действие антигистаминных препаратов.
Антилейкотриеновые препараты хорошо переносятся больными, не приводят к развитию серьезных осложнений [38]. Важным является то обстоятельство, что они применяются в таблетированной форме один-два раза в день.
Последние исследования показывают, что антагонисты лейкотриенов могут быть использованы в качестве альтернативы кортикостероидной терапии при устойчивой астме легкого течения [21, 27]. Антагонисты лейкотриенов снижают дозу ингаляционных кортикостероидов при обострении астмы.
Лейкотриен D4, действуя на гладкую мускулатуру бронхов, не влияет на синтез ДНК, содержание РНК, коллагена, эластина, бигликана, фибронектина [29]. Некоторые антилейкотриены активировали в печени микросомальную активность и аминотрансферазы.
Антилейкотриены эффективны при индукции бронхоспазма аллергенами, холодным воздухом, физическими упражнениями, аспирином. Клинические наблюдения осуществлены, как в течение короткого, так и длительного наблюдения [23].
Антагонисты лейкотриенов позволяют снизить дозировку других препаратов, используемых для лечения бронхиальной астмы, в частности, b2-агонистов [18]. В настоящее время признано, что лучшим противовоспалительным эффектом обладают кортикостероиды. В то же время, при их длительном применении могут возникать серьезные побочные эффекты [40]. Многие пациенты испытывают трудности при пользовании устройствами для ингаляции, так как ее необходимо проводить несколько раз в день. Отмечены случаи развития локальной и системной толерантности к кортикостероидам [18, 41]. Необходимы дальнейшие исследования в целях определения их эффективности при совместном применении с ингаляционными кортикостероидами [14, 39].
Таким образом, открытие нового класса медиаторов воспаления – лейкотриенов, идентификация связывающих их рецепторов позволили создать новое направление в лечении бронхиальной астмы на основе разработки препаратов, являющихся ингибиторами лейкотриеновых рецепторов. Клиническое применение препаратов этой группы – монтелукаста натрия, зафирлукаста, пранлукаста свидетельствуют о несомненной терапевтической эффективности. Они предотвращают развитие бронхоспазма (в т.ч., в ночное время), препятствуют развитию воспаления, отека, уменьшают проницаемость сосудов, снижают секрецию слизи, улучшают качество сна, снижается использование бета-агонистов. Препараты эффективны при лечении пациентов, страдающих легкой и умеренно выраженной бронхиальной астмой. Это является исключительно важным с точки зрения предотвращения прогрессирования заболевания и развития тяжелых форм бронхиальной астмы.
Литература
1. Адо В.А., Мокроносова М.А., Перламутров Ю.Н. Аллергия и лейкотриены: обзор // Клиническая медицина, 1995, 73, N2, с 9-12
2. Актуальные проблемы пульмонологии (Под ред. А.Г. Чучалина) // М., “Универсум Паблишинг”, 2000
3. Бабак C.Л., Чучалин А.Г. Ночная астма // Русск. мед. журнал, 1998, 6, N7, с 11080-1114
4. Бабак С.Л. Клинические аспекты терапии больных с синдромом обструктивного апноэ-гипопноэ сна с помощью неинвазивной вентиляции легких постоянным положительным давлением в дыхательных путях. // Автореферат дисс. канд. мед. наук, М., 1997
5. Бронхиальная астма. (Под ред. А.Г. Чучалина). М.,”Агар”, 1997
6. Булкина Л.С., Чучалин А.Г. Антилейкотриеновые препараты в лечении бронхиальной астмы // Русск. мед. журн., 1998, т.6, N 17, с 1116-1120
7. Ковалева В.Л., Чучалин А.Г, Колганова Н.А. Антагонисты и ингибиторы лейкотриенов в терапии бронхиальной астмы // Пульмонология, 1998, 1, с 79-87
8. Колганова Н.А., Осипова ГЛ., Горячкина Л.А и др. Аколат – антагонист лейкотриенов, новый препарат для базисной терапии бронхиальной астмы // Пульмонология, 1998, N 3, с 24-28
9. Мокроносова М.А., Адо В.А., Перламутров Ю.Н. Роль лейкотриенов в патогенезе аллергических заболеваний: обзор // Иммунология, 1996, N 1, с 17-28
10. Синопальников А.И. “Аколат” – антагонист лейкотриенов, препарат нового класса для базисной терапии бронхиальной астмы // Моск. мед. журнал, 1999, февраль, с 28-29
11. Федосеев Г.Б., Емельянов А.В., Краснощекова О.И. Терапевтические возможности антилейкотриеновых препаратов у больных бронхиальной астмой: обзор // Терапевт, архив, 1998, 78, N8, с 81-84
12. Цой А.Н, Шор О.А. Новое в лечении бронхиальной астмы: ингибиторы лейкотриенов: обзор // Терапевт, архив, 1997, 69, N 2, с 83-88
13. Busse W. The role and contribution of leukotrienes in asthma. Ann Allerg. Asthma Immunol., 1998, 81 (1), p 17-26
14. Chanes P., Bougeard Y., Vachier I. et al. Leukotriene antagonists. A new therapeutic approach in asthma // Presse Med., 1997, 26 (5), p 234-239
15. Chung К., Holgate S. Leukotrienes: why are they important tors in asthma? // Eur. Respir. Rev., 1997, 7, 46, p 259-263
16. De Lepebire I, Reiss Т., Rochette F. et al. Montelukast causes prolonged, potent leukotriene D4-receptor antagonism in the airways of patients with asthma // Clin. Pharmacol. Ther., 1997, 61(1), p 83-92
17. Devillier P., Baccard N., Advenier C. Leukotrienes, leukotriene receptor antagonists and leukotriene synthesis inhibitors in asthma: an up. Part 1: synthesis, receptore and role of leukotrienes in asthma // Pharmacol. Res., 1999, 40 (1), p 3-13
18. Devillier P., Millart H., Advenier C. Les anti-leukotrienes; leur posifionnement dans I yasthma // Rev. Med. Brux., 1997, 18 (4), p 279-285
19. Diamant Z., Grootendorst D., Veselic-Charvat M. et al. The effect of montelukast (MK-0476), a cysteinyl leukotriene receptor antagonist, on allergen-induced airway responses and sputum cell in asthma // Clin. Exp. Allergy, 1999, 29 (1), p 42-51
20. Drasen L.M. Effects of Cysteinyl Leukotrienes on Human Airways // SRS-A to Leukotrienes. The Dawning of a New Treatment Proceeding of a scientific meeting held at Oakley Coury, London, 8-10 October 1996, p 189-201
21. Gani F., Senna G., Givellaro M. et al. New drugs in the treatment of respiratory – allergic discases. Nuovi farmaci nella terapia delle allergopatie respiratorie // Recenti-Prog. Med., 1997, 88 (7-8), p 333-341
22. Holgate S.T, Dahlen S-E. From Slow Reacting Substance to Leukotriene: A Testimony of Scientific Endeavour and Achievement // SRS-A to Leukotrienes. The Dawning of a New Treatment Proceeding of a scientific meeting held at Oakley Coury, London, 8-10 October 1996, p 1
23. Ind P. Anti-leykotriene intervention: is there deguate rmation for clinical use in asthma // Respir. Med., 1996, 90 (10), p 575-586
24. Israel E. Leukotriene Inhibitors //Asthma, 1997, vol. 2, p 1731-1736
25. MacKay TW, Brown P, Walance W, et aL Does inflammation play a role in nocturnal asthma? // Am. Rev. Respir. Dis., 1992, 145, A22.
26. Manisto J, Haahtela T. New drugs in astha treatment. Leukotreiene receptor blockers and leukotriene synthesis inhibitors // Nord, Med., 1997, 112 (4), p 122-125
27. Марр С. Ruolo degli antagonisti di un singolo tore nella terapia dell asma // Ann. Ital. Med. Int., 1998, Jan-Mar, 13 (1), p 24-29
28. Oosterhoff Y, Kauffman HF, Rutgers et al. Inflammatory cell number and tors m bronchoalveolar lavage fluid and peripheral blood in subjects with asthma with increased nocturnal airways narrowing // Allergy Clin. Immunol., 1995, 96 (2), p 219-229.
29. Panettieri R., Tan E., Ciocca V et al. Effects of LTD4 on human airway smooth muscle cell proliferation matrix expression and contraction in vitro differential sensitiviti to cysteinyl leukotriene receptor antagonists // Am. J. Respir. Cell. Mol. Biol, 1998, 19 (3), p 453-461
30. Pauwels R. Treayment of asthma with anti-leukotrienes: current and Future Trends // SRS-A to Leukotrienes. The Dawning of a New Treatment Proceeding of a scientific meeting held at Oakley Coury, London, 8-10 October 1996, p 321-324
31. Pauwels R., Joos J., Kips J. Leukotrienes as therapentic target in asthma // Allergy, 1995, 50, p 615-622
32. Reiss Т., Chervinsky P., Dockhorn R. et al. Montelukast, a once-daily leukotriene receptor antagonists in the treatment of chronic asthma: a multicenter, randomized, double-blind trial / Montelukast Clinical Re Study Group // Arch. Intern. Med., 1998, 158 (11), p 1213-1220
33. Reiss Т., Sorkness С., Stricker W. et al. Effects of montelukast (MK-0476): a potent systeinyl leukotriene receptor antagonist, on bronchodilation in asthmatic sybjects treated with and without inbhaled corticosteroids // Thorax, 1997, 52 (1), p 45-48
34. Samuelsson В. The Discovery of the Leukotrienes and the Structure Elucidation of SRS-A // SRS-A to Leukotrienes. The Dawning of a New Treatment Proceeding of a scientific meeting held at Oakley Coury, London, 8-10 October 1996, p 39-49
35. Smith J. Leukotrienes in asthma. The potential therapeutic role ofantileukotriene agents // Arch. Intern. Med., 1996, 156 (19), p 2181-2189
36. Spector S. Management of asthma with zafirlukust. Clinical experience and tolerability profils // Drugs, 1996, 52, Suppl 6, p 36-46
37. Tan R. The role ofantileukotrienes in asthma management // Curr. Opin. Pulm. Med., 1998, 4 (1), p 25-30
38. Tan R. , Spector S. Antileukotriene agents // Curr. Opin. Pulm. Med., 1997, 3 (3), p 215-220
39. Taylor L.K. Measurements of Leukotrienes in Asthma // SRS-A to Leukotrienes. The Dawning of a New Treatment Proceeding of a scientific meeting held at Oakley Coury, London, 8-10 October 1996, p 203-234
40. Wagener M. Neue Entwicklungen in der Asthma therapic, Wie wirken die sinzelnen Leukotrien antagonisten // Schweiz.-Rundsch. Med Prax., 1998, 87 (8), s 271-275
41. Wenzel S. New approaches to anti-inflammatory therapy for asthma // Am. J. Med 1998, 104 (3), p 287-300
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Источник
